Sok dolog előkerült már a gombákkal kapcsolatban hónapról hónapra, de így az utolsó hivatalos bejegyzés előtt visszanézve még rengeteg mindenről lehetne írni.
Ilyen például a gombák országának elhelyezése az élővilágban. A Whittaker-féle osztályozással (1. Ábra) valószínű már mindenki találkozott.
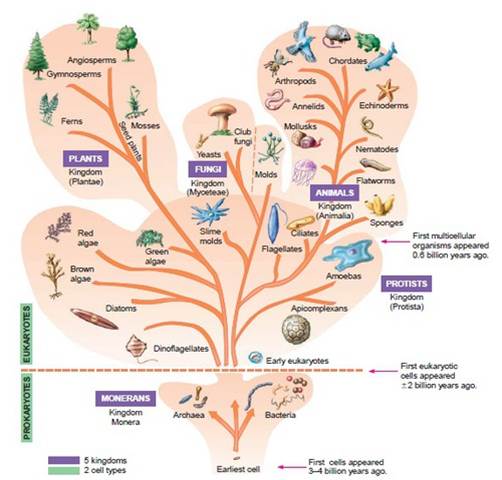
1. Ábra. Az élőlények Whittaker-féle rendszere. Forrás: http://quizlet.com/11674553/marjorries-notes-bio-chapter-1-flash-cards/
Ezen belül gombák országának legfontosabb törzsei:
-Rajzóspórás gombák („vízigombák”; Chytridiomycota). Vízhez kötött életmód miatt nevezik így, a többi törzsre már sem a vegetatív, sem a szexuális reprodukció nem kapcsolódik szorosan vízi környezethez. Ivartalan szaporodásnál zoosspórák, ivarosnál egyostoros planogaméták jellemzőek (2. A Ábra).
-Járomspórás gombák (Zygomycota). Ivaros szaporodásnál zigospóra képzés jellemző, míg ivartalan szaporodás során sporangiospórák képződnek. Legismertebb képviselői a fejespenészek (2. B. Ábra).
-Tömlősgombák (Ascomycota). Az összes ismert gomba 30%-a ide tartozik. Aszkuszt és aszkospórákat képeznek ivaros szaporodás során, ivartalannál konídiumot. Ok jól ismert növény és humán patogén faj mellett (pl. Aspergillus nemzetség tagjai, 2. C. Ábra), a Bipolaris nemzetség is ebbe a csoportba tartozik.
-Bazídiumos gombák (Basidiomycota). A legfejlettebb csoport. Ivaros szaporodás során a bazídiumon bazídiospórák képződnek (2. D. Ábra).
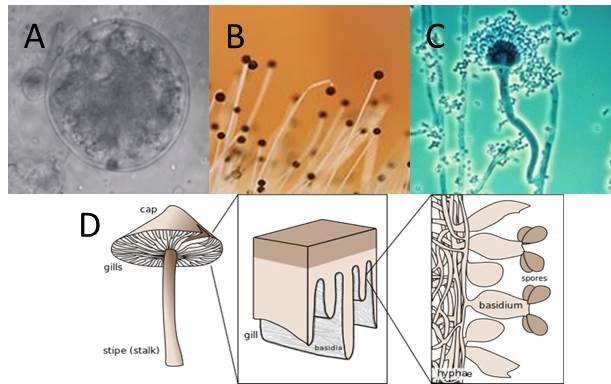
2. Ábra. A legfontosabb törzsek egy-egy képviselője az alábbiak szerint: A - Chytridiomycota (http://en.wikipedia.org/wiki/Chytridiomycota); B- Zygomycota (http://www.nahuby.sk/images/fotosutaz/2008/12/28/Mucor-sp-/ivan_kadlecik_141360.jpg); C - Ascomycota (http://upload.wikimedia.org/wikipedia/commons/4/4f/Aspergillus.jpg); D - Basidiomycota (http://2.bp.blogspot.com/-RHV6GmY1bss/UlCdbpBMepI/AAAAAAAAD0Q/k6XuB6op1Vs/s1600/mushroom+basidia.jpg)
.
Most, hogy ez is a helyére került zárszóként egy kis összefoglalót tartanék az elmúlt évről.
Az opportunista patogén Bipolaris fajokra irányuló kutatásom során a „Bemutatkozik a mikrobio.blog” című bejegyzésben foglaltam össze a kutatás céljait részletesen. Ha rendszeresen követtétek a blogot, láthattátok ennek folyamatos megvalósulását is, aminek nagyon örültem. Emellett, hogy a kutatásunk szélesebb szakmai körökben is ismert és hasznosítható legyen, több publikáció és konferencia szereplés is történt időközben, ezekből a teljesség igénye nélkül felsorolnék néhányat. Egy publikáció már megjelent, illetve egy jelenleg bírálat alatt áll egy külföldi referált folyóiratban. Hazai konferenciákon és szemináriumokon, illetve négy külföldi szakmai konferencián is részt vehettem eredményeimmel. Emellett négy hallgatóval ismertettem meg a kutatás során használt különböző vizsgálati módszereket. Mindezek mellett egy oktatási segédanyag is elkészült a témában és természetesen a blog frissítésein keresztül bárki belepillanthatott a kutatás aktuális szakaszába. Mint láthatjátok elég tartalmasan telt az elmúlt évem, remélem nektek is hasonlóan sikeres volt J
Hivatalosan ugyan ez volt az utolsó bejegyzés, de annyi érdekesség jutott még eszembe, hogy valószínűleg a blog folytatódni fog.
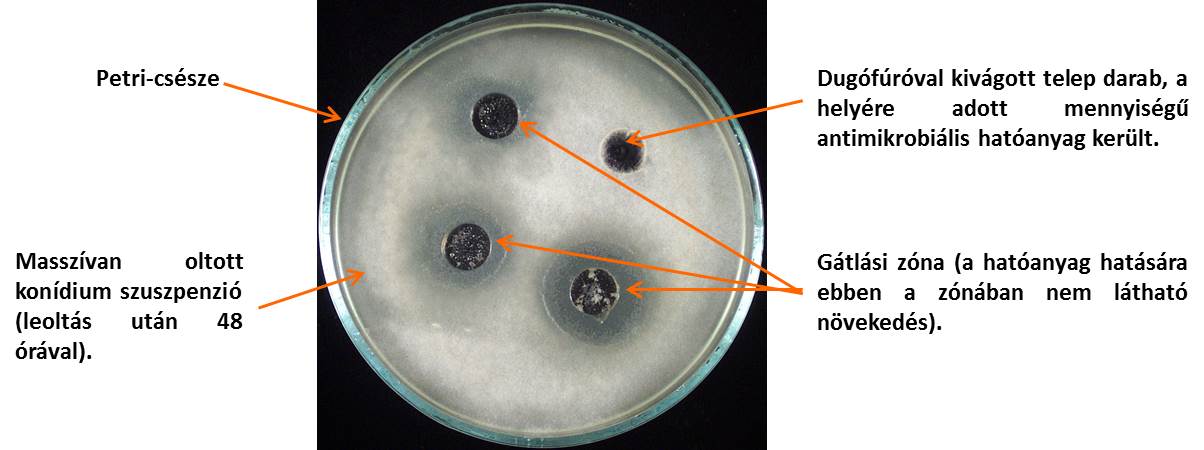

 Az ábrán egy szénforrás hasznosításra használt gyorsteszt látható, melyen a CBS 103.97 törzsgyűjteményi számú B. hawaiiensis izolátum szénhidrát hasznosítási profilját vizsgáltuk. Minden zsebben más-más szénhidrátra specifikus reakció van, a pozitív eredményt színváltozás jelöli (24., 25. zseb).
Az ábrán egy szénforrás hasznosításra használt gyorsteszt látható, melyen a CBS 103.97 törzsgyűjteményi számú B. hawaiiensis izolátum szénhidrát hasznosítási profilját vizsgáltuk. Minden zsebben más-más szénhidrátra specifikus reakció van, a pozitív eredményt színváltozás jelöli (24., 25. zseb).